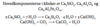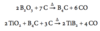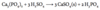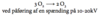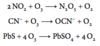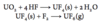13-Ugers periode Flashcards
(178 cards)
Hvilken type bindinger danner grundstofferne i 5. hovedgruppe?
Nitrogen og fosfor laver covalente bindinger. Arsen laver netværk-covalente bindinger. Antimon og bismuth laver metalliske bindinger.
Hvilken type bindinger danner grundstofferne i 2. periode?

Hvilke type bindinger danner grundstofferne i 3. periode?

Hvilken bindingstype er der tale om i de højeste fluorider af grundstofferne i 2. periode?
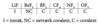
Hvilken bindingstype er der tale om i de højeste fluorider af grundstofferne i 3. periode?

Hvilken bindingstype er der tale om i de højeste oxider af grundstofferne i 2. periode?

Hvilken bindingstype er der tale om i de højeste oxider af grundstofferne i 3. periode?

Hvilken bindingstype er der tale om i hydriderne af grundstofferne i 2. periode?
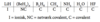
Hvilken bindingstype er der tale om i hydriderne af grundstofferne i 3. periode?

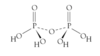
Angiv syre/base egenskaberne af de højeste oxider af grundstofferne i 3. periode

Angiv syre/base egenskaberne af de højeste oxider af grundstofferne i 5. hovedgruppe

Hvorledes kan H2 fremstilles industrielt og i laboratoriet?

Stiger eller falder reaktiviteten mellem H2 og halogenerne ned gennem 7. hovedgruppe?
Reaktiviteten mellem dihydrogen og halogenerne falder ned gennem 7. hovedgruppe.
Beskriv hvordan H2 kan anvendes som reduktionsmiddel

Hvorledes kan hydriderne af grundstofferne i det periodiske system karakteriseres som henholdsvis ioniske, kovalente eller metalliske?
Hydriderne af grundstofferne i 1. og 2. hovedgruppe kan karakteriseres som ioniske.
Hydriderne af overgangsmetallerne kan karakteriseres som metalliske.
Hydriderne af grundstofferne i 3. til 7. hovedgruppe kan karakteriseres som covalente.
Begrund hvorfor vands og flussyres kogepunkt er væsentligt højere end forventet
Intermolekylære hydrogenbindinger.


Beskriv henholdsvis lithiums reaktion med atmosfæren (oxygen og kuldioxid) samt alkalimetallernes reaktion med vand

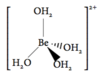
Forklar hvorfor Li+ er exceptionel god til at koordinere vand
Li+ har godt nok kun én positiv ladning. Til gengæld er Van der Walls radius af ionen relativt lille hvilket fører til en relativt høj ladningstæthed (ladning pr. volumen). Det er ladningstætheden der afgører ionens evne til at koordinere
vand.

Opskriv alkalimetallernes flammefarver

Hvilken sammenhæng er der mellem opløseligheden af et salt, kationens radius og anionens radius?

Opskriv reaktionen mellem nitrogen og et alkalimetal der har en rød flammefarve og høj ladningstæthed. Opskriv da produktets reaktion med vand.
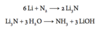
Beskriv med ord og reaktionsskema hvorledes lithium indgår i genopladelige Lithium-Ion batterier

Beskriv med reaktionsskema hvorledes lithium indgår i ikke-genopladelige batterier