Examen final Flashcards
(34 cards)
Qu’est-ce qu’un récepteur (R)?
Les récepteurs sont généralement de grosses molécules, qui présentent un site de reconnaissance pour les ligands (poche qui interragit spécifiquement avec certains ligands, sans ses interractions spécifiques il n’y a pas de réponse) et des régions qui permettent d’interagir avec d’autres protéines pour induire un signal cellulaire. Il active donc son effecteur en présence d’un agoniste. Selon la conformation que le récepteur adoptera lorsque le ligand se fixera dans la poche réceptrice, il y aura des interactions ou non avec certaines protéines pour induire un signal.
*Un même récepteur peut activer plusieutrs voies de signalisation selon la conformation qu’il prend. Donc, une même famille de molécules peut avoir des effets différents à partir du même R.
*Les récepteurs les plus répendu sont les récepteurs couplés à la protéines G.
*Par contre, ce ne sont pas que les molécules endogènes qui sont médiées par l’action des récepteurs (Par ex, des molécules qui agissent sur le pH (antiacide), l’osmose ou des chélateurs de métaux lourds).
Où se trouve un récepteur?
- Incorporé dans des membranes.
- Associé à des membranes (à la surface intracell/extracell)
- Associé à d’autres structures telles que l’ADN
- Solubles (ex. dans le sang)
Quelles substances sont considérées comme des récepteurs?
- Neurotransmetteurs, les hormones, etc.
- Des enzymes qui sont inhibés par des agents pharmacologiques
- Des protéines de transport comme la Na+-K+-ATPase
- Des protéines structurales comme la tubuline
Qu’est-ce qu’un récepteur associé à une protéine G? (où, forme et mode de fonctionnement)
- Les récepteurs couplés à la protéine G sont incorporés à la membrane.
- Le récepteur associé à la protéine G a 7 domaines transmbranaires (séquence d’A.A. qui traverse 7x la membrane) pour induire une réponse. Elle comporte une partie terminale externe (L-terminale) et interne (C-terminale).
- Le ligand se lie à la poche réceptrice du récepteur à 7 passages transmbranaires, puis induit un changement de conformation chez celle-ci, ce qui va activer la protéine G, qui sera impliquée dans une cascade de signalisation.

Nomme quelques exemples de récepteurs couplés aux protéines G.
- Adrénergique ß2.

Qu’est-ce qu’un récepteur à activité tyrosine kinase ? (où, forme, mode de fonctionnement)
- Les récepteurs à activité tyrosine kinase sont incorporés à la membrane.
- Les RTK sont tous des récepteurs transmembranaires monomériques, à l’exception de celui pour l’insuline, qui est un hétérodimère associé à un pont disulfure, donc tétramérique. Donc, soit qu’ils possèdent 1 ou 2 domaine transmbranaires.
- Différents ligands peuvent se lier au RTK, donc l’insuline, EGFR, PDGFaR et TRKA. Lorsque le ligand bivalent lie le RTK, il entraîne la dimérisation du RTK, cette dimérisation entraîne ensuite une phosphorylation du domaine intracellulaire via l’enzyme de type tyrosine kinase et des protéines cytoplasmiques vont alors venir se lier au domaines phosphorylés du RTK et induire différentes réponses intracellulaires.

Qu’est-ce qu’un ligand?
Un ligand est une substance biologiquement active qui exerce son action en agissant via un récepteur (ex. drogues, hormones, neurotransmetteurs, toxines, etc.). Le mot ligand n’indique pas si l’effet sera positif ou négatif.
*Ce ne sont toutefois pas que les substances biologiquement actives qui interagissent avec un récepteur (ex: les gaz anesthésiques engendrent un changement au niveau de la constitution des membranes ou les molécules qui agissent sur pH)
*Il est possible de classer les ligands de différentes façons soit en termes d’affinité soit en termes de mode d’action.
Définissez les deux trypes de liaison récepteur-ligand.
Il existe deux types d’activation, soit les spécifiques (facilement saturable) et aléatoire ou non spécifique (virtuellement insaturable), la liaison ligan-récepteur totale est l’addition des deux. Lorsqu’il y a une liaison spécifique, le ligand se fixe dans une poche du récepteur et interagit de façon spécifique pour induire un changement de conformation du récepteur.
Quelles sont les carractéristiques des liaisons spécifiques? (4)
- L’affinité: L’affinité est la probabilité qu’un médicament occupe un récepteur à un moment donné. Plus l’affinité est forte plus les probabilités qu’un ligan produise un effet est grand via sa liaison avec son récepteur. *En général, lorsque l’affinité d’un ligand pour un récepteur est forte, plus la concentration du ligand dans le corps est faible (car il est majoritairement lié à son R et la concentration nécessaire est moins élevée).
- La saturabilité: Les sites de liaison spécifique ont un nombre limité et il est donc théoriquement possible de les saturer (de tous les occuper). À l’opposé le nombre de sites de liaison non spécifiques a un nombre pratiquement illimité et ils ne sont pas saturables.
- La réversibilité: La réversibilité est la mesure de la proportion du ligand qui est libéré du complexe ligand-récepteur sous sa forme identique (donc ne prend pas en compte les enzymes). La réversibilité dépend dirrectement de la force de liaison entre le ligan et le récepteur et influence la dynamique du médicament.
- La stéréospécificité: La stéréospécificité est la variation de l’activité selon l’isomère optique utilisé et si un isomère a une activité préférencielle.
Comment la variation de l’affinité peut-elle être démontré?
Nous pouvons faire cette expérience pour démontrer qu’un ligand a plus d’affinité pour un récepteur donné qu’un autre ligand :
Nous mettons la même quantité de ligands radioactifs dans une série de tubes avec une concentration croissante du ligand non radioactif que l’on veut étudier. Plus on ajoute un ligand non radioactif, moins de ligands radioactifs vont lier le récepteur jusqu’à un minimum, car selon la loi de l’effet de masse, les ligands non-radioactifs vont prendre toute la place. Dans l’exemple que vous allez voir, chaque image représente un tube qui contient le même nombre de récepteurs et la même quantité de ligands radioactifs (noir). Le nombre de ligands non radioactifs (orange) augmente dans chacun des tubes et, éventuellement, il va occuper tous les récepteurs. Tous les ligands radioactifs seront déplacés.

Quelles-sont les données disponibles dans une courbes d’affinité? (2)
- Si l’on compare une courbe de déplacement avec un ligand non-radioactif à une autre courbe engendré par un autre ligand, nous pouvons déterminer leur affinité relative. Plus la conste d’affinité est grande (Kd), moins le ligand a d’affinité pour un R, car Kd représente la concentration de ligand nécessaire pour que celui-ci occupe 50% des sites. Ainsi, la quantité nécessaire, pour déplacer les radioligands des R, d’un ligand avec une grande affinité pour le R (petit Kd) sera bcp + petite qu’un ligand avec une petite affinité (grand Kd). Dans l’exemple qui suit, la quantité de ligands bleus nécessaires pour déplacer 50% de la liaison est moins grande que la quantité de ligands verts. Comme la quantité est plus petite, le ligand bleu a une meilleure affinité.
- Il est peossible de déterminer le pourcentage des différents sous-types d’un récepteur dans une préparation et leur affinité relative pour le ligand. Cela est possible, car on commence à déplacer le sous-type de récepteur qui a la meilleure affinité pour le ligand froid. Par la suite on peut déplacer le deuxième sous-type qui a une affinité plus faible pour le ligand froid. Le saut représente la quantité de chacun des sous-types.

Explique l’affinité avec l’exemple des récepteur adrénergique ß1 et ß2.

Comment la saturabilité peut-elle être déterminée?
Grâce à une courbe de saturation qui se fait à l’aide de deux séries de tubes qui contiennent la même quantité de récepteurs (sites de liaison).
Dans les deux séries de tubes, nous augmentons la concentration de ligand radioactif jusqu’à ce que nous obtenions un plateau.
Dans la seconde série de tubes, nous ajoutons en plus, une concentration de ligand non radioactif, pour lequel le récepteur a de l’affinité, plusieurs fois supérieures à la concentration de ligand radioactif. Ainsi dans la seconde série de tubes, le ligand non radioactif devrait occuper tous les sites de liaison, ne laissant qu’au ligand radioactif la possibilité de lier les sites non spécifiques. Ligand qui est non spécifique n’est pas déplacé, car la la liaison se fait par hasard.
La première série de tubes permet d’avoir la liaison totale (spécifique + non spécifique) alors que la deuxième série de tubes permet de calculer la liaison non spécifique.
La soustraction de la courbe totale et de la courbe de liaison non spécifique nous permet de calculer la courbe de saturation spécifique.
La courbe des liaisons spécifiques devrait toujours être supérieur à la courbe des liaisons non-spécifique, à moins que le liguand n’est pas une affinité particulire pour sa cible, ce qui correspond à un échec pharmacologique.

Quelles-sont les données disponibles dans la courbe de saturabilité?
- Bmax: Le nombre de site de liaison (Bmax) derterminé grâce à la courbe de saturabilité des liaisons spécifiques.
- Kd: Le Kd est la concentration de radioligand requise pour occuper 50% de la population totale des récepteurs.Plus la valeur de Kd est petite, meilleure est l’affinité du ligand pour les sites de liaison spécifique.

Prouvez mathématiquement qu’à Kd, 50% des sites de liaisons disponibles sont occupés.

Prouvez mathématiquement la formule du taux d’occupation.
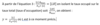
Quels-sont les différents types de réversibilité? (3)
- Liaison réversible (La plupart des ligands physiologiques et pharmacologiques).
- Liaison quasi irréversible (Composés toxiques ex: venim).
- Liaison irréversible (Surtout utilisée dans un contexte d’études structurales).
Comment la réversibilité peut-elle être démontré?
Ce critère peut être démontré par l’augmentation du volume dans laquelle une réaction se produit. Par exemple, si la réaction se fait dans un volume de 1 ml, une fois l’état d’équilibre atteint, il y a aura autant de ligands qui se fixent aux récepteurs, que de ligands qui se détachent des récepteurs.
Si une fois l’équilibre atteint, on augmente le volume de la réaction, disons à 100 ml, sans changer le nombre de récepteurs ou la quantité de ligands, le temps qu’un ligand libre vienne s’associer à un récepteur va augmenter parce que la distance entre les deux est plus grande. Il y aura donc moins de ligands associés à un récepteur à tout moment. Néanmoins après un certain temps, un nouvel état d’équilibre sera atteint, mais le nombre de molécules liées sera moins grand dans 100 ml que lorsque la réaction avait lieu dans 1 ml (si on ne change pas le nombre de récepteurs et de ligands)

Quelles sont les modes d’actions des ligands sur les récepteurs? (4)
- Agoniste: Induit une réponse biologique lorsqu’il se lie à son récepteur. (Permet une réponse)
- Agoniste partiel: capable d’induire un effet,
mais moins efficace qu’un agoniste.
- Antagoniste: Se lie au récepteur, mais incapable d’induire une activation. (N’active pas le récepteurs, ne permet pas de réponse) *Si ajoute antagoniste à l’agoniste, il y a moins de chance d’observer une activation importante.
- Agoniste inverse: Réduit la réponse de base.

Quels-sont les types d’antagonistes?
- Antagoniste chimique (irréversible): La liaison entre un antagoniste chimique et le site du récepteur se fait par l’intermédiaire de liaisons covalentes.
- Antagoniste compétitif: L’antagoniste compétitif est carractérisé par une compétition avec l’agoniste pour le même site de liaison au récepteur. Ce sont donc l’affinité et la concentration des deux partenaires qui déterminent celui qui se liera au récepteur. Si la concentration de l’antagoniste compétitif augmente sans changement dans la quantité de l’agoniste, l’antagoniste déplacera l’agoniste.
- . Antagoniste non-compétitif: L’antagoniste correspond à la fixation de l’antagoniste sur un site de liaison distinct du site de liaison de l’agoniste et inhibe la réponse d’un agoniste, quelle que soit sa concentration.
- Antagoniste fonctionnel: L’antagoniste fonctoionnel correspond à une interaction résultant à des processus biochimiques cellulaires distincts. (Exemple: sur une même cellule, l’agoniste d’un récepteur peut entraîner une contraction et l’agoniste d’un autre récepteur une relaxation: les deux agonistes ont des effets antagonistes).
Quels sont les types d’agonistes?
- L’agoniste inverse: L’agoniste inverse diminue l’activité constitutive (de base) d’un R. Ce ligand amène le récepteur actif dans la conformation Ri (forme inactive).
- L’agoniste protéan: L’agoniste protéan est un ligand pouvant se comporter simultanément comme agoniste, agoniste inverse et antagoniste sur le même récepteur ( Ra à Ra’) ou (Ri à Ra’).
- L’agoniste biaisé: Un agoniste est dit « biaisé » lorsque sa liaison avec le récepteur induit une conformation du récepteur qui mène à l’activation d’une partie des voies de signalisation du récepteur par l’intermédiaire d’un seul effecteur (protéine G, arrestine) sans activer d’autres effecteurs.
Expliquez à l’aide d’une mise en situation comment l’environnemnet peut influencer l’effet d’un agoniste.
Environnement aussi peut avoir un effet. Par exemple, si on prend un récepteur et que l’on le met en contact avec des protéines Gs, celle-ci vont être activées, et on observe que le ligand 1 est le meilleur (lui qui prend la + petite conc pour produire 50% de l’effet max). Mais quand la conformation du récepteur est différente (syst enrichi), il est possible de voir qu’en utilisant les mêmes mol, le 2 est meilleur que le 1. Donc, ordre complètement différent.
Donc, lr ligand a un effet sur R, mais l’environnement a aussi un effet. Alors, si on donne de la médication à 2 personnes, l’effet peut varier à cause de l’environnement.

Donnez deux exemples d’application thérapeutique des agonistes inverses.
- Le cancer: Les récepteurs a1-adrénergiques sont des proto-oncogènes, ils favorise dév de cancer. On traite donc avec agoniste inverse les personnes atteinte de cancers pour diminuer le niveau d’activation de base et donc pour diminuer les chances de déveloper le cancer.
- Le syndrome de Cushing: Dans cette maladie, certains récepteurs développent une mutation qui les rend actif continuellement, donc ils produisent énormément de la catécholamine. Si on donne un agoniste inverse, cela diminue la quantité de catécholamine produite.
Expliquez ls effets d’un agoniste inverse à l’aide de l’exemple des transporteurs ßAR2.





