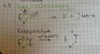OC1 Flashcards
(68 cards)
Radikal
- Verbindung mit Ungepaarten Elektronen reaktive
- Zwischenstufe
- stabiele: NO, NO2
- Erzeugung: Bindungsspaltung (Homolyse) Aus Radikalen (Kettenreaktion) Singel elektron transfer
BDE
H-H 436 kJ/mol
C-H 400-430 kJ/mol
C-C 350 kJ/mol
Hammond Postulat
Halogenalkane
Siede- und Schmelzpunkt höher als Alkane
Ursache : polare Bindungen(Dipol)
Reaktion: Sn und E
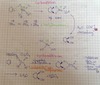
Nucleophile
Neutrale Verbindungen mit freiem Elektronenpaar oder Anion
Bsp.: OH-, OR-, Br-, NH3, H2O, Cl-
Nucleophile Substitutuion SN
SN1 oder SN2
- abhängig von Substrat
- abhängig vom Lösungsmittel
- abhängig von der Abgangsgruppe
- abhängig von der Natur des Nucleophils
Nucleophil reagiert mit Elektrophil
hart?
Weich?
HSAB-Konzept?
hart
Ladungen ziehen sich an (Reaktion ist Ladungsgetrieben), keine allg. gültige “Nucleophilie” Nucleophil ist u.a. abhängig vom Elektrophil
weich
Gute Überlappung von Orbitalen (Reaktion ist Orbitalgetrieben)
HSAB
hart reagiert mit hart
weich reagiert mit weich
ambidente Nucleophile
Bildung von C-O-Bindungen
Lsg.:Sulfonate
Eliminierungsreaktion