Chapitre 1 : Organisation de la matière Flashcards
(20 cards)
Qu’est-ce que le tableau périodique ?
Tableau organisé de tout les éléments, classé en ordre de numéro atomique et de masse.
Quels sont les informations qu’on peut retrouver dans un tableau périodique.
- Nom de l’élément
- Symbole de l’élément
- Numéro atomique
- Masse atomique
- État de l’élément
Quel est la différence entre un atome et une molécule ?
Un atome est la plus petite particule de matière
Une molécule est un regroupement d’au moins 2 atomes
Quel est la différence entre un élément et un composé ?
- Un élément est une substance composé d’une seule sorte d’atomes
- Un composé est une molécule composé d’atomes différents
Qu’est-ce qu’une formule chimique ?
Utilise 3 H2O pour expliquer la différence entre les coefficient, les éléments et les indices.
Une formule chimique représente les molécules.
Exemple : 3 H2O
Le 3 représente un coefficient. Les coefficients se retrouvent devant les molécules. Ici ça veut dire qu’on a 3 molécules d’H2O.
Le H et le O représente les deux éléments qui compose la molécule d’eau soit l’hydrogène et l’oxygène.
Le petit 2 est un indice. Il représente le nombre de fois qu’on retrouve l’élément de gauche dans la molécule. Ici on a donc 2 hydrogènes. À côté du O il n’y a pas d’indice ça veut dire qu’il y en a 1 seul.
Dans la molécule suivante combien il y a d’atome de Fer (Fe)
Fe2O3
2 atomes de fer
Dans 4 KI, combien il y a de molécule ?
4
Dans 3 Ca(OH)2 , combien il y a d’atome d’oxygène au total ?
6
Quel est la différence entre Co et CO ?
Co est un atome de cobalt et CO est une molécule comprennant du carbone et de l’oxygène.
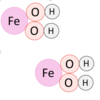
Dessin la molécule suivante : 2 Fe(OH)<sub>2</sub>
Qu’est ce que la loi de la conservation de la matière ?
Rien ne se perd, rien ne se crée, tout se transforme
Le nombre d’atomes dans les réactifs doit être égal au nombre d’atomes dans les produits.
La masse des réactifs est égal à la masse des produits
Je fais réagir 10 g d’H2 avec 3g d’O2. Quel sera la quantité de H2O formé ?
2 H2 + O2 –> 2 H2O
10g + 3g = 13g
Je fais réagir 22 g de HCl avec 8g d’NaOH. Quel sera la quantité de NaCl formé sachant qu’il y a 15 g d’eau ?
HCl + NaOH –> NaCl + H2O
22 + 8 = 30
30 - 15 = 15
15 g de NaCl
Vrai ou faux
Que ce soit une réaction chimique ou physique, la conservation de la matière est toujours respectée dans un système fermé hermétiquement.
Vrai
Vrai ou faux
À partir d’une molécule de glace (H2O), on peut créer 2 molécules de d’eau liquide.
Faux
Je veux faire réagir du bicarbonate avec du vinaigre. Avant la réaction, je pèse le tout. La masse est de 35 g. Je mélange le vinaigre et le bicarbonate dans un bécher. En reprèsant (sans la masse du bécher) j’observe que la masse à diminué. Elle est rendu de 30g. Pourquoi ?
C’est probablement parce qu’un gaz c’est produit lors de la réaction. Celui-ci c’est échappé parce qu’il n’y svait de couvercle sur le bécher. La masse du gaz est donc de (35-30 = 5) 5 g.
Dans la formule suivante :
HCl + NaOH –> NaCl + H2O
a) Quelles substances sont les produits ?
b) Quelles substances sont les réactifs?
a) produits = NaCl et H2O
b) réactifs = HCl + NaOH
La réaction suivante est-elle équilibré ?
HCl + NaOH –> NaCl + H2O
Oui
Est-ce que tout les éléments ont des symboles différents ?
Oui, pour que les scientifiques puissent se comprendre dans les équations chimiques.
Exemple de bonus de l’examen :
KF2 + F2 –> KF3
2 KF2 + F2 –> 2 KF3


