Cancerläkemedel Flashcards
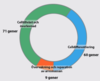
Vid avgränsade tumörer används
- Kirurgi
-
Radioterapi (stråla bort)
- Ges till 50 % av cancerpatienter och står för 30 % av bot
- Kombineras ofta med cytostatika, hormonbehandling etc
- Extern (strålkällan utanför kroppen) eller?
Brakyterapi (källan placeras invid eller i tumören)
Vilka tre typer av övergripande behandling används vid spridd tumör?
Immunoterapi, medikamentell behandling och målspecifik terapi
Immunoterapi
- Tumörceller kan bära många mutationer i DNA och immunsystemet är nedreglerat, men immunsystemet kan stimuleras/aktiveras för mer aktivitet mot tumörceller
- B7 känns först igen av CD28 men sen uppregleras CTLA-4 som då binder B7 och nedreglerar immunsvaret
Vad kan göras för att behandla detta?

Antikropp kan tillsättas som binder CTLA-4 och CD28 uppregleras igen –> immunsvar
- Stor risk för autoimmunitet
- Tumörer med många mutationer svarar bäst

Medikamentell behandling
- Traditionell medicinering utan kunskap om carcinogenes med mkt biverkningar
- Kemoterapi (cytostatika)– proliferarande celler mer känsliga för DNA-skador och mitoshämning, dessa LM ger biverkan av de celler som också vanligtvis har mitos
Hur fungerar antimetaboliter?
Hämmar syntes/metabolism av DNA
- Antimetaboliter är ämnen som liknar någon av kroppens olika byggstenar eller signaleringssystem, men är inte funktionella så kan därför stoppa celler från att dela sig. Det finns exempelvis kopior av byggstenarna i DNA, som kommer att sättas in som en felaktig bas i DNA-sekvensen vilket leder till att cellen dör. Det finns även antimetaboliter som blockerar ett ämne kallat folsyra, som krävs för celltillväxt.
- Basanaloger/nukleosidanaloger – modifierade baser, hämmar syntes (celldöd),
- Funkar inte med nukleotid (fosfatgrupp också) då de inte passerar membranet
- Methotrexat hämmar DHFR vilket ger minskad syntes av dTMP (behövs för DNA-syntes)
- Kemoterapi (cytostatika)– proliferarande celler mer känsliga för DNA-skador och mitoshämning, dessa LM ger biverkan av de celler som också vanligtvis har mitos
Hur fungerar topoisomerashämmare?
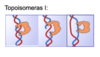
Topoisomeras håller DNA-molekyl lagom lös (inte för hårt tvinnad)
- Hämning leder till strängbrott, eftersom klyvning sker men ligering uteblir, strängbrotten sker ofta vid replikationsgaffeln (prolifererande celler)

- Kemoterapi (cytostatika)– proliferarande celler mer känsliga för DNA-skador och mitoshämning, dessa LM ger biverkan av de celler som också vanligtvis har mitos
Hur fungerar mikrotubulihämmare?
- Vincaalkaoider hämmar polymerisering
- Taxaner hämmar depolymerisering
- Cancerceller både hög mitos och proteinsyntes, 30 % av alla nysyntetiserade proteiner är felveckade och bryts ner av proteasomen, därför viktig för tumören
- God effekt vid multipelt myelom
Vad är det som har god effekt?
Vad för typ av läkemedel är detta?
Proteashämmare
Kemoterapi/cytostatika
Vad beror kemoterapiresistens på utöver begränsat terapeutiskt fönster (dosbegränsning)?
- Dödar konstant fraktion (%), stor tumör ger då många återstående tumörceller
- Återväxt mellan terapiomgångar som kan mutera och utveckla resistens (ex fler transportörer som skickar ut LM, mindre upptagningsproteiner etc)
Nämn minst fyra vanliga biverkningar vid kemoterapi/cytostatika
- Benmärgshämning (de flesta cytostatika) – blodbrist, måste kontrolleras
- Illamående/kräkning
- Alopeci
- Diarré/förstoppning
- Hormonella biverkningar
- Mukosit (slemhinnor påverkan)
- Hormonterapi – bröstcancer ofta beroende av östrogen för proliferation
Hur fungerar tamoxifen och vilka kollaterala effekter har den?
- Tamoxifen liknar östrogens struktur och hämmar östrogen-R kompetativt och hämmar därmed tillväxt
Tamoxifen antagonist i vissa celler men östrogenagonist i benmärg (motverkar osteoporos) och uterus (hypetrofi ☹)

Aromatashämmare – hämmar östrogensyntes
Varför fungerar dessa bäst hos postmenopausala kvinnor?
- Östrogensyntes sker främst i perifera vävnader hos äldre kvinnor
- Om man hämmar östrogensyntes i ovarier hos premenopausala kvinnor finns feedbackloop som hämmar detta

Vad innebär målspecifik terapi (tageted therapy)?
- LM som riktar sig specifikt mot cancerspecifika mekanismer (mutationer, ex)
- Mutationer ger förändrade proteiner som driver cancercellens tillväxt
- LM binder/hämmar här specifikt cancerproteiner
- Viktigt veta hur många cancerspecifika proteiner det finns

Vad menas med att målspecifik terapi har större terapeutiskt fönster?
Mindre biverkningar
Målspecifik terapi
- LM binder/hämmar här specifikt cancerproteiner
- Viktigt veta hur många cancerspecifika proteiner det finns
Hur många finns det i regel?
- Vuxna 50-100 (lungcancer hos rökare betydligt fler jämför med icke rökare med lungcancer)
- Barn 4-5
- Många är säkert passengers, räcker troligen med 4-5 stycken drivers (Hallmarks)

Målspecifik terapi
Som nämnt tidigare
- Viktigt veta hur många cancerspecifika proteiner det finns
- Vuxna 50-100 (lungcancer hos rökare betydligt fler jämför med icke rökare med lungcancer)
- Barn 4-5
Många är säkert passengers, räcker troligen med 4-5 stycken drivers (Hallmarks), hur vet vi detta?
Hur många drivers har vi hittat?
- De mekanistiskt viktiga finns i många olika tumörer, varför de blir lättare att hitta, p53-genen, PI3KCA, RAS-genen osv
- 140 drivers upptäckta