Kapitel 11: Einführung und Kohlenwasserstoffe Flashcards
(38 cards)
Kohlenwasserstoffe
Verbindungen, die ausschliesslich aus Kohlenstoff und Wasserstoff aufgebaut sind.
E.g. Ethan, Methan, Ethen, Ethin, …
Alkane
Gesättigte Kohlenwasserstoffe, homologe Reihenfolge, CnH2n+2
Ab Butan (C5H12) können hier Konstitutionsisomere auftreten.
Homologe Reihe
Eine homologe Reihe liegt vor, wenn chemisch nahe verwandte Verbindungen sich durch ein gleich bleibendes Strukturelement in der Summenformel unterscheiden.
(e.g. bei Alkanen: CH2 Gruppe)
Konstitutionsformel
Bei Konstitutionsisomerie werden die verschiedenen Strukturformeln auch als Konsitutionsformeln bezeichnet.
Konstitutionsisomerie
Man bezeichnet eine Verbindung, die die gleiche Summenformel, aber unterschiedliche Strukturformeln besitzen, als Konstitutionsisomere.
E.g. Butan und 2-Methylpropan
Konformer
σ-Bindungen sind rotationssymmetrisch. Daher können C-C Bindungen rotieren.
Es existieren daher e.g. für das Ethen Molekül verschiedene rotationsisomere Anordnungen.
Konformer = Rotationsisomer
gestaffelt, ekliptisch
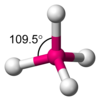
Keilstrichformel
Macht die normale Strukturformel räumlich anschaulicher.
Keile werden für Bindungen verwendet, die aus der Papierebene zum Leser stehen.
Gestrichelte Linien für Bindungen, die weg vom Leser, nach hinten gehen.
Cycloalkane
“Zusammengeschlossene, kreisförmige Alkane”
CnH2n
Nomenklatur: Cyclo-[Name Alkan]
e.g. Cyclohexan
cis/trans-Isomerie (Cycloalkane)
Für die physikalischen Eigenschaften relevante Isomerie der Cycloalkanderivate (Subsituenten für mehrere H).
Trans: ein Substituent oberhalb, einer unterhalb der Ringebene
Cis: beide Substituenten auf derselben Ringseite
cis = “selbe Seite”, trans = “entgegengesetzt”
Substitution
Zum Beispiel “radikalische Substitution”. Ein Atom wird durch ein Anderes ersetzt.
Radikal
Atom oder Molekül mit einem ungepaarten Valenzelektron. Sehr reaktiv.
Entstehen unter anderem beim homolytischen Bindungsbruch.
Homolytischer Bindungsbruch
Jeder Partner erhält ein Elektron aus dem ursprünglich gemeinsamen Elektronenpaar.
Führt zu Radikalen.
Heterolytischer Bindungsbruch
Ein Partner erhält beide Elektronen aus dem ursprünglich gemeinsamen Elektronenpaar.
Führt zu Ionen.
Radikalische Halogenierung
Läuft für die Halogene Fluor, Chlor, Brom und Iod unterschiedlich ab.
Gibbs-Aktivierungsenergie
Chlor: exergon
Brom: endergon
Iod: fungiert jeglich als Radikalfänger (radikalische Iodierung existiert nicht.
Kettenreaktion

Rekombination
Die Vereinigung von zwei Radikalen nennt man Rekombination.
Zum Beispiel werden zwei Chlor-Radikale zu Cl2
Radikalfänger
Zum Beispiel Iod.
Bindet existierende Radikale und produziert dabei keine neuen Radikale (kann nur rekombiniert werden).
(Gibbs-)Aktivierungsenergie
Die Energie, die zum Erreichen des Übergangszustands benötigt wird, bezeichnet man als Gibbs-Aktivierungsenergie ΔG#
Alkene
Alkene sind Kohlenwasserstoffe, die mindestens eine C/C Doppelbindung enthalten. E.g. Ethen, Propen, Cyclobuten
Nucleophil
= Kern-Liebend (negative Ladung)
Ein Nucleophil ist ein Elektronenpaardonator.
- elektronenreiche π-Bindungen
- freie Elektronenpaare eines Anions
- freie Elektronenpaare eines Dipolmoleküls
Elektrophil
= Elektronen liebend (positiv geladen)
Ein Elektrophil ist ein Kation oder eine Gruppe mit positiver Polarisierung (elektrophiles Zentrum).
Elektronenlücke, die von einem Partner aufgefüllt werden kann (Elektronenpaarakzeptor).
Olefine
= Alkene
Diene
Alkadiene/ Diene
Verbindungen mit zwei Doppelbindungen werden Alkadiene oder kurz Diene genannt.
Nomenklatur wie gewohnt.
Carbenium-Ion