Cancerogenes Flashcards
(60 cards)
Varför har cancerfall per år ökat från 70-talet och framåt?
Hur många få cancer under sin livstid?
- Delvis beroende på ökad medellivslängd, dock inte hela förklaringen
- 1/3 får cancer under livet
Varför finns det kulturella skillnader gällande cancertyper ho befolkningen?
- Beror mkt på kulturella skillnader, ex betelnötter i Asien (cancerframkallande i esofagus)
- Spegling av riskfaktorer i dessa områden

Hur kan vi se att magsäckscancern i Japan främst beror på miljlön och hereditet (nutrition, hårt grillad fisk ex skapar cancerframkallande ämnen vilket tas upp i lever)
Migrationsstudier
- Hos japaner som flyttat till USA går frekvens av lever/magsäcks-cancer ner
- Nästa generation fortsatte tendensen

- Lungcancerökning hos manliga engelska läkare, går direkt relatera till ökad rökning
- Hos kvinnliga läkare ses en långsammare ökning av rökning varpå det ses långsammare ökning av lungcancer
- Varför kan vi kalkylera att kvinnors utveckling av bröstcancer i lungor kommer öka?
Latenstid från exponering till drabbning

Vad kan vi dra för slutsats av att 85-90 % av all cancer har ursprung i de livsfaktorer som vi exponeras för (kemikalier, strålning, virus, bakterier osv), det vill säga, vad innehåller de?
Att cancerceller innehåller somatiska mutationer och/eller epigenetiska (förändring i hur gener uttrycks) t ex
Hur kan ett främmande exogent ämne framkalla cancer?
- Oftast fettlösliga, behöver därför inga transportproteiner
- Diffunderar in i membranet enkelt
- Kemisk struktur känns igen av proteiner/enzymer vilket i bensens fall gör att det kommer metaboliseras till en molekyl med OH-grupp och sedan kan det ske vidare konjugeringar och den blir mer vattenlöslig och kan skickas ur cellen på nytt
- Men sker ofta reaktiva mellansteg där de kan reagera med proteiner/DNA vilket kan bilda kemiska föreningar (kovalent bundna metaboliter i DNA) vilket i nästa cell kan ge mutation

Varför borde du sluta äta jordnötter?
- Jordnötter som lagras fel i varma länder t ex bildar aflatoxin som
- Metaboliseras och bildar epoxid som binder in till DNA-molekyl och bildar mutationer
- Krävs bara små mängder för att utveckla cancer
På vilket sätt gör miljöfaktorer och genetisk konstitution att vi utvecklar cancer?
Samspel

Vilka är de två viktigaste Hallmarks of cancer och hur förhåller sig deras genes gällande dominant/recessiv?
-
Oncogener (gas) – Kan aktiveras t ex om mutation eller förändrad genexpression (ex en epigenetisk förändring, förändring av genuttrycket) – ger gain of function
- Dominant (räcker på ena genen (mors eller fars))
-
Suppresorgener (broms) – ger negativa signaler och minskar hastighet av proliferation
- Recessiv
Hur fungerar care takers och vad händer när de muteras?
Den tredje Hallmarken
- DNA-reparationsgener
- Håller genomet stabilt, undviker mutationsgener
- Mutationer på dessa gör att de reparerar sämre varför andra mutationer ökar
Nämn minst tre generella sätt som en ONCO-gen kan ge GAIN OF FUNCTION?
- Kan ske genom translokation av genen (överkorsning av kromosomerna), kan därför hamna på ny kromosomal plats, erhåller då t ex ny promotor (den nya promotorn stimulerar kanske i högre utsträckning vilket ger mkt mer av proteinet), gendosökning liksom (detta är ingen mutation)
- Vid celldelning kan amplifiering ske (flera kopior av genen) vilket gör att det produceras mer protein
- Även förändringar som ligger utanför genen, t ex promotorn vilket ökar transkriptionen av genen (mutation av promotorn), vilket ökar mängden protein
- mutation i proteinet (ex en nukleotidförändring) vilket gör att koden förändras och vi får ett annat protein

Vilka generella procancer-egenskaper kan ett somatiskt muterat protein få?
- Bryts inte ner lika lätt
- Mer effektiv (hyperaktivt protein) som kan stimulera ex tillväxt (inte mer av proteinet men snabbare liksom)
Vad är det mest sannolika resultatet av ett slumpvis somatiskt muterat protein?
Ett sämre protein vilket inaktiverar (likviderar) den muterade genen

Translokation av ONCO-genen c-myc är vanligt förekommande vid cancer, vad händer när detta sker?

- Igh-promotorn kontrollerar då uttrycket av c-myc som ökar
När MYC ökar i koncentration tränger den bort fler av MAX-proteinerna vilket ger en MYC-MAX heteromer som binder till DNA och stimulerar/aktiverar transkription av gener som är intressanta för cellcykeln och cellproliferation/tillväxt

Philadelphiakromosomen bildas efter en translokering där det börjar kodas för ett protein som ses vid kronisk myoelid leukemi.
Vilken Hallmarkegenskap har detta protein och vad är det som sker?
ONCO-gen
- Genen ABL (från kromosom 9) translokeras till kromosom 22
- ABL-genens axon hamnar tillsammans med BCR-gen vilket ger ett fusionsprotein, en del BCR och en del ABL
- som är ett ett kinas som stimulerar fosforylering och signalvägar i cellens blodceller (vita blodkroppar) och ger proliferation och bildning av yolid arm
- Sker i blodets stamceller i benmärg
- För att bota måste stamceller i benmärgen strålas så att dessa celler dödas av och sedan individ transplanteras med vita blodkroppsproducerande celler

RAS är en viktig ONCO-gen och sitter intracellulärt, precis innanför membran, när tillväxtfaktor binder leder det till olika fosforyleringar som i slutändan stimulerar transkriptionsfaktorer. Hur kan den muteras och vad blir dess resultat?
- Är en ONCO-gen, kan muteras i tre olika positioner som håller GTP
- Vanlig mutation på aminosyra 12 vid cancer där glycin byts till valin vilket gör att GAP inte kan inaktivera RAS vilket gör signalvägen ständigt aktiv (fastnar i ON-state)
Missense-mutation i antingen kodon 12, 13 eller 61 aktiverar RAS proteiner
(RTK = receptor tyrosinkinas

Vad är fosfatidylinositol-3-kinas (PIK3CA) vanliga funktion?
- Tillväxtfaktorer binder till receptor tyrosinkinas vilket ger autofosforylering av proteiner och PIK3CA (P110 och p85)
- Som också överför fosfotgrupper (men inte till protein) till lipiden PIP3 (tre fosfatgrupper vid aktivering)
- Denna kan användas av andra kinaser för att aktivera AKT som kan aktivera en mängd vägar; reparation, cellcykelstopp, apoptos mm.

Vilken Hallmark-typ är PIK3CA?
ONCO-gen
Hur muterar PIK3CA som cancergen och vilken effekt får den?
- Specifika positioner på PIK3kinaset kan muteras och ge mer fosforylering av PIP3 vilket stimulerar fosforylering av AKT som aktiverar en mängd vägar

Vad gör PTEN?
- PTEN (fosfatas), tar bort fosfatgrupper från PIP3 och minskar aktiveringen PIK3CA– Tumörsuppresor

Tumörsuppressorgener
- Hämmar eller motverkar cellproliferation
- Funktion som försvinner (därför svårare att identifiera)
- Recessiv
- Familjära fall (dvs att risken att utveckla cancer i retina fanns i familjen men också sporadiska fall utan denna härledning)
- I de familjära fallen fanns mutationen i en av allelerna av föräldrarna som ärvdes av barnet, en muterad och en frisk allel som kan upprätthålla funktion, men om retina var känslig för ytterliggare mutatin som inaktiverar andra allel så försvinner bromsande funktionen av proliferationen
- I de sporadiska fallen fick pat. först en mutation i en cell och senare en andra mutation för att inaktivera bägge celler vilket är sällsynt
- Situationen ovan är vanligare
Vad kallas denna teori för?
Kallas för second hit då första hiten givits av föräldrar

Tumörsuppressorgenen RB är den första upptäckta tumörsuppressorn och inaktiveras helt (oftast) enligt second hit-teorin.
Hur verkar den i vanliga fall?
- Aktiv vid restriktionspunkten i cellcykeln
- När cellen får stimulering (signaler utifrån) om celldelning, associerar cyklin D och cyklin D beroende kinas och fosforylerar retinoblastomprotein (RB) innan S-fas
- I vanliga fall binder RB upp transkriptionsfaktorn E2F och fosforyleringen leder till att RB släpper iväg E2F för ”lagom stimulering” och cellcykeln kan gå in i S-fas
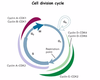
Tumörsuppressorgenen RB är den första upptäckta tumörsuppressorn och inaktiveras helt (oftast) enligt second hit-teorin.
- Genen är i vanliga fall aktiv vid restriktionspunkten i cellcykeln
- När cellen får stimulering (signaler utifrån) om celldelning, associerar cyklin D och cyklin D beroende kinas och fosforylerar retinoblastomproteinprotein (RB) i G1
- RB binder upp transkriptionsfaktorn E2F och fosforyleringen leder till att RB släpper iväg E2F för ”lagom stimulering” och vidare push till S-fas
Hur verkar den när den är muterad?
- När RB (tumörsupressor) är muterat, binder den inte E2F, de förblir separerade vilket lämnar E2F fritt att stimulera t ex replikation
- Nedärvd mutation gör att cellproliferation stimuleras hela tiden, framför allt då om vildtyp är förlorad ”second hit” - retinoblastom

p53 agerar tumörsuppressor, hur agerar den i normalfallet vid stress (DNA-skada, hypoxi etc)?
- Då aktiveras protein ATM (kinas) som fosforylerar p53 som släpper från sitt hämmande protein MDM2 och kan binda DNA för att stimulera transkription som p21 som hämmar cyklin D så det inte kan fosforylera RB och därmed inte släppa E2F vilket ger ett cellcykelstopp innan S-fas
- Då får cellen tid för DNA-reparation/eliminera olika stressfaktorer som hydroxiradikaler osv, om cellen inte lyckas kan p53 transkribera apoptosgener – bättre att cellen dör än att dra på sig mutationer
- MDM2 binder i vanliga fall upp p53 och stimulerar till ubiquitinering och degradering av proteasom
- p53 reglerar också MDM2 (negativ feedback) så cellens nivåer av P53 hålls i normalfallet låga
- p53 agerar också i G2 innan M-fas
















